Berikut pembahasan soal-soal OSN Kimia tingkat kabupaten/kota tahun 2025. Pada postingan ini disajikan khusus soal-soal tentang termokimia/termodinamika. Soal tentang bahasan ini berjumlah 6 item soal.
Bahasan Soal OSN Kab/Kota 2025 Bidang Kimia lainnya dapat dibaca pada tautan berikut:| Bagian-1 | Bagian-6 |
| Bagian-2 | Bagian-7 |
| Bagian-3 | Bagian-8 |
| Bagian-4 | Bagian-9 |
| Bagian-5 | Bagian-10 |
Soal OSN Kab/Kota tentang Termokimia/Termodinamika-1
Es pada suhu 0 °C ditempatkan dalam cangkir styrofoam yang berisi 361 g minuman ringan pada suhu 23 °C. Panas jenis minuman tersebut hampir sama dengan panas jenis air. Sebagian es tetap ada setelah es dan minuman ringan mencapai suhu keseimbangan 0 °C. Abaikan kapasitas panas cangkir. Jika diperlukan 334 J untuk mencairkan 1 g es pada 0 °C dan kalor jenis air 4,184 J.g–1.°C–1, maka massa es yang telah mencair adalah ....
- 84 g
- 94 g
- 104 g
- 114 g
- 124 g
Pembahasan Soal Termokimia
Diketahui:
- Suhu awal es (\( T_{\text{es}} \)) = 0°C
- Massa minuman (\( m_{\text{minuman}} \)) = 361 g
- Suhu awal minuman (\( T_{\text{minuman}} \)) = 23°C
- Suhu kesetimbangan (\( T_{\text{setimbang}} \)) = 0°C
- Kalor jenis minuman (\( c \)) ≈ kalor jenis air = 4,184 J/g°C
- Kalor lebur es (\( L_f \)) = 334 J/g
- Sebagian es tetap tidak mencair, sehingga suhu akhir campuran adalah 0°C.
Ditanyakan:
Massa es yang telah mencair (\( m_{\text{es}} \)).
Penyelesaian:
-
Kalor yang dilepaskan oleh minuman saat mendingin dari 23°C ke 0°C:
Minuman melepaskan kalor karena suhunya turun. Kalor yang dilepaskan (\( Q_{\text{minuman}} \)) dapat dihitung dengan:
$$ \begin{aligned} Q_{\text{minuman}} &= m_{\text{minuman}} \cdot c \cdot \Delta T \\ &= 361 \, \text{g} \times 4,184 \, \text{J/g°C} \times (23°C - 0°C) \\ &= 361 \times 4,184 \times 23 \\ &= 361 \times 96,232 \\ &\approx 34.740 \, \text{J} \end{aligned} $$ -
Kalor yang diserap oleh es untuk mencair:
Kalor yang dilepaskan oleh minuman digunakan untuk mencairkan sebagian es. Karena suhu es tetap 0°C, semua kalor digunakan untuk perubahan fase (melebur), bukan untuk menaikkan suhu. Kalor yang diserap es (\( Q_{\text{es}} \)) adalah:
$$ \begin{aligned} Q_{\text{es}} &= m_{\text{es}} \cdot L_f \\ &= m_{\text{es}} \times 334 \, \text{J/g} \end{aligned} $$ -
Prinsip Kesetimbangan Kalor:
Kalor yang dilepaskan minuman sama dengan kalor yang diserap es:
$$ \begin{aligned} Q_{\text{minuman}} &= Q_{\text{es}} \\ 34.740 \, \text{J} &= m_{\text{es}} \times 334 \, \text{J/g} \\ m_{\text{es}} &= \frac{34.740}{334} \\ &\approx 104 \, \text{g} \end{aligned} $$
Jawaban yang tepat adalah C.
Soal OSN Kab/Kota tentang Termokimia/Termodinamika-2
Jika suatu reaksi dilakukan pada 50 °C, laju reaksi meningkat sebanyak 10 x lipat dibandingkan pada 25 °C. Energi pengaktifan reaksi tersebut adalah ....
- +73,71 kJ.mol–1
- –73,71 kJ.mol–1
- +147,42 kJ.mol–1
- –147,42 kJ.mol–1
- +12,15 kJ.mol–1
Perhitungan Energi Pengaktifan Reaksi Kimia
Diketahui:
- Laju reaksi meningkat 10 kali lipat
- Suhu awal (T1) = 25°C = 298 K
- Suhu akhir (T2) = 50°C = 323 K
- k2/k1 = 10
- R = 8,314 J/mol.K
Persamaan Arrhenius:
Langkah Penyelesaian:
Kesimpulan:
Energi pengaktifan (Eₐ) bernilai positif karena merupakan energi yang harus disuplai (ditambahkan) untuk mengaktifkan reaksi.
Soal OSN Kab/Kota tentang Termokimia/Termodinamika-3
Suatu gas mengembang volumenya dari 26,7 mL menjadi 89,3 mL pada suhu konstan. Kerja yang terlibat jika gas mengembang pada ruang hampa dan tekanan konstan 2,8 atm sebesar....
- 0 dan –18 J
- 0 dan 18 J
- 0 dan –9 J
- –9 dan –18 J
- 9 dan 18 J
Pembahasan Soal Termodinamika
Gas mengembang dari \( V_1 = 26,\!7 \text{ mL} \) ke \( V_2 = 89,\!3 \text{ mL} \) pada suhu konstan.
Hitung kerja yang terlibat dalam dua kondisi:
Gas Mengembang dalam Ruang Hampa
Dalam ruang hampa, tekanan eksternal \( P_{\text{luar}} = 0 \), sehingga:
$$ \begin{aligned} W &= -P_{\text{luar}} \Delta V \\ &= -0 \times (89,\!3 - 26,\!7) \\ &= 0 \text{ J} \end{aligned} $$Gas Mengembang pada Tekanan Konstan \( 2,\!8 \text{ atm} \)
Kerja dihitung dengan:
$$ \begin{aligned} W &= -P \Delta V \\ &= -P(V_2 - V_1) \\ &= -2,\!8 \text{ atm} \times (89,\!3 \text{ mL} - 26,\!7 \text{ mL}) \\ &= -2,\!8 \text{ atm} \times~ \!62,6 \text{ mL} \\ &= -2,\!8 \text{ atm} \times 0,\!0626 \text{ L} \\ &= -0,\!17528 \text{ L.atm} \end{aligned} $$Mengonversi satuan (\( 1 \text{ L.atm} = 101,\!325 \text{ J} \)):
$$ \begin{aligned} W &= -0,\!17528 \times 101,\!325 \text{ J} \\ &\approx -17,\!76 \text{ J} \\ &\approx -18 \text{ J} \end{aligned} $$Hasil Akhir
- Kerja dalam ruang hampa: \( 0 \text{ J} \)
- Kerja pada tekanan \( 2,\!8 \text{ atm} \): \( -18 \text{ J} \)
Jawaban yang tepat A.
Soal OSN Kab/Kota tentang Termokimia/Termodinamika-4
Istilah hidrogen ekonomi didasarkan pada hidrogen yang diproduksi dari air menggunakan energi matahari. Gas tersebut kemudian dibakar sebagai bahan bakar:
2H2(g) + O2(g) → 2H2O(l)
Energi yang dihasilkan oleh pembakaran gas hidrogen akan disetarakan dengan pembakaran bahan bakar oktana. Diketahui massa jenis oktana adalah 2,66 kg/galon, entalpi pembentukan standar oktana adalah –249,9 kJ/mol, entalpi pembentukan standar CO2 adalah –393,5 kJ/mol, dan pembentukan standar H2O adalah –285,8 kJ/mol. Volume gas hidrogen pada 25 °C dan 1 atm yang diperlukan untuk menghasilkan sejumlah energi yang setara dengan yang dihasilkan oleh pembakaran satu galon oktan (C8H18) adalah ....
- 10,89 L
- 108,98 L
- 497,8 L
- 1089,80 L
- 10898 L
Perhitungan Hidrogen Ekonomi
Menghitung kalor pembakaran 1 mol oktana
Reaksi:
\[ C_8H_{18} + \tfrac{25}{2}O_2 \rightarrow 8CO_2 + 9H_2O(\ell) \]
Hitung entalpi reaksi:
\[ \begin{aligned} \Delta H_{\text{pembakaran}} &= \left[8(-393{,}5) + 9(-285{,}8)\right] - (-249{,}9) \\ &= -5720{,}0 + 249{,}9 \\ &= -5470{,}1\ \text{kJ/mol} \end{aligned} \]
Menghitung energi dari 1 galon oktana
Massa jenis oktana: 2,66 kg/galon = 2660 g
\[ \begin{aligned} n_{C_8H_{18}} &= \frac{2660}{114,23} \\ &= 23,286 \, \text{mol} \end{aligned} \] \[ \begin{aligned} q &= 23,286 \times 5470,1 \\ &\approx 1,27376 \times 10^5 \, \text{kJ} \end{aligned} \]Menghitung jumlah mol H2 yang diperlukan
Reaksi:
\[ 2H_2 + O_2 \rightarrow 2H_2O(\ell) \]
\[ \begin{aligned} \Delta H &= 2(-285{,}8) = -571{,}6\ \text{kJ} \\ \text{per mol } H_2 &= -285{,}8\ \text{kJ} \end{aligned} \]
\[ \begin{aligned} n_{H_2} &= \frac{1{,}27376 \times 10^5}{285{,}8} \\ &\approx 445{,}69\ \text{mol} \end{aligned} \]
Menghitung volume H2 pada 25 °C dan 1 atm
\[ \begin{aligned} V &= \dfrac{nRT}{P} \\ &= \dfrac{445{,}69 \times 0{,}08205 \times 298}{1} \\&=10897,52\ \text{L}\\ &\approx 10898\ \text{L} \end{aligned} \]
Jawaban yang tepat E.
Soal OSN Kab/Kota tentang Termokimia/Termodinamika-5
Sebanyak 200 mL HCl 0,862 M dicampur dengan 200 mL Ba(OH)2 0,431 M dalam kalorimeter bertekanan konstan dengan kapasitas kalor yang dapat diabaikan. Suhu awal larutan HCl dan Ba(OH)2 adalah sama pada 20,48 °C. Asumsikan bahwa massa jenis dan kalor jenis larutan sama dengan air (masing-masing 1,00 g/mL dan 4,184 J.g–1.°C–1), dan kalor netralisasi adalah –56,2 kJ/mol. Suhu akhir larutan tersebut adalah ....
- 8,9 °C
- 14,7 °C
- 26,3 °C
- 32,1 °C
- 40,0 °C
Perhitungan Suhu Akhir Reaksi Netralisasi HCl dan Ba(OH)2
Reaksi Netralisasi
Persamaan reaksi: $$\text{Ba(OH)}_2 + 2\text{HCl} \rightarrow \text{BaCl}_2 + 2\text{H}_2\text{O}$$
Menghitung mol masing-masing zat
\[ \begin{aligned} \text{Mol HCl} &= 0{,}862\,\text{M} \times 0{,}200\,\text{L} = 0{,}1724\,\text{mol} \\ \text{Mol Ba(OH)}_2 &= 0{,}431\,\text{M} \times 0{,}200\,\text{L} = 0{,}0862\,\text{mol} \end{aligned} \]
Karena 1 mol Ba(OH)2 bereaksi dengan 2 mol HCl, maka:
0,0862 mol Ba(OH)2 membutuhkan 0,1724 mol HCl → reaksi sempurna
Menghitung mol air yang terbentuk
Dari reaksi: \[ \text{mol H}_2\text{O} = 2 \times 0{,}0862 = 0{,}1724\,\text{mol} \]
Menghitung kalor yang dilepaskan
\[ q = \text{mol H}_2\text{O} \times \Delta H_{\text{netralisasi}} = 0{,}1724 \times 56{,}2 = 9{,}69\,\text{kJ} \]
Menghitung perubahan suhu larutan
Total volume larutan = 200 mL + 200 mL = 400 mL → massa = 400 g
Kalor jenis air = 4,184 J/g°C
\[
\begin{aligned}
q &= m \cdot c \cdot \Delta T \\
9690\,\text{J} &= 400\,\text{g} \cdot 4{,}184\,\text{J/g°C} \cdot \Delta T \\
\Delta T &= \frac{9690}{1673{,}6} \approx 5{,}79^\circ \text{C}
\end{aligned}
\]
Menghitung suhu akhir
\[ T_{\text{akhir}} = T_{\text{awal}} + \Delta T = 20{,}48^\circ\text{C} + 5{,}79^\circ\text{C} = 26{,}27^\circ\text{C} \]
Jawaban yang tepat C.
Soal OSN Kab/Kota tentang Termokimia/Termodinamika-6
Perhatikan data berikut:
Perubahan entalpi untuk reaksi 2C(grafit, s) + 2H2(g) → C2H6(g) adalah sebesar ....
- +84,6 kJ/mol
- –84,6 kJ/mol
- +3204,2 kJ/mol
- –3204,2 kJ/mol
- –3798,9 kJ/mol
Perhitungan ΔH dengan Jalur Langsung dari 3 Reaksi (Hukum Hess)
Kita ingin menentukan perubahan entalpi untuk reaksi:
1. Data Reaksi Pembakaran yang Diberikan
- $$\mathrm{C(s) + O_2(g) \;\longrightarrow\; CO_2(g)} \quad \Delta H_1 = -393{,}5\ \text{kJ}$$
- $$\mathrm{2H_2(g) + O_2(g) \;\longrightarrow\; 2H_2O(g)} \quad \Delta H_2 = -571{,}6\ \text{kJ}$$
- $$\mathrm{2C_2H_6(g) + 7O_2(g) \;\longrightarrow\; 4CO_2(g) + 6H_2O(g)} \quad \Delta H_3 = -3119{,}6\ \text{kJ}$$
2. Sesuaikan dan Balik Reaksi
- Balik reaksi (3) dan kalikan 1/2 agar membentuk satu mol etana: $$2CO_2(g) + 3H_2O(g) \;\longrightarrow\; C_2H_6(g) + \tfrac{7}{2}O_2(g) \qquad \Delta H_3' = \tfrac{1}{2}(+3119{,}6) = +1559{,}8\ \text{kJ}$$
- Kali 2 reaksi (1) supaya menghasilkan 2 mol CO₂: $$2C(s) + 2O_2(g) \;\longrightarrow\; 2CO_2(g) \qquad \Delta H_1' = 2(-393{,}5) = -787{,}0\ \text{kJ}$$
- Kali \(\tfrac{3}{2}\) reaksi (2) agar menghasilkan 3 mol H₂O: $$3H_2(g) + \tfrac{3}{2}O_2(g) \;\longrightarrow\; 3H_2O(g) \qquad \Delta H_2' = \tfrac{3}{2}(-571{,}6) = -857{,}4\ \text{kJ}$$
3. Menjumlahkan Ketiga Reaksi
Gabungkan dan coret spesies yang sama di kedua sisi:
Setelah mencoret \(CO_2\), \(H_2O\), dan \(O_2\):
4. Hitung ΔH Total
5. Hasil
Perubahan entalpi untuk reaksi di atas adalah \(-84,6\ \text{kJ}\).
Jadi jawaban yang tepat B.


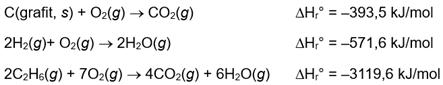

Tidak ada komentar:
Posting Komentar