Berikut pembahasan soal-soal OSN Kimia tingkat kabupaten/kota tahun 2025. Pada postingan ini disajikan khusus soal-soal terkait struktur atom, ikatan kimia, stoikiometri, dan kristal. Total jumlah item soal sebanyak 6.
Bahasan Soal OSN Kab/Kota 2025 Bidang Kimia lainnya dapat dibaca pada tautan berikut:
| Bagian-1 | Bagian-6 |
| Bagian-2 | Bagian-7 |
| Bagian-3 | Bagian-8 |
| Bagian-4 | Bagian-9 |
| Bagian-5 | Bagian-10 |
Soal OSN Kab/Kota tentang Struktur Atom
Perhatikan tabel energi ionisasi berikut untuk unsur periode 3.
Urutan jari-jari atom yang benar adalah ....
- A > B > C > D
- D > B > A > C
- A > C > B > D
- D > A > B > C
- B > A > C > D
Pembahasan Soal Energi Ionisasi dan Jari-jari Atom
Langkah-langkah Penyelesaian:
-
Identifikasi Unsur Berdasarkan Pola Energi Ionisasi
Energi ionisasi menunjukkan jumlah elektron valensi suatu unsur. Lompatan besar terjadi saat elektron berikutnya harus diambil dari kulit yang lebih dalam.- A: Lonjakan besar dari ke-7 ke-8 (11000 → 33604) → 7 elektron valensi → Klorin (Cl), Z = 17
- B: Lonjakan besar dari ke-6 ke-7 (8490 → 27107) → 6 elektron valensi → Sulfur (S), Z = 16
- C: Tidak ada lonjakan tajam, dan hanya sampai data ke-8. Ini menunjukkan konfigurasi penuh pada kulit ketiga (3s²3p⁶), sehingga kemungkinan besar merupakan gas mulia Argon (Ar), Z = 18
- D: Lonjakan besar dari ke-3 ke-4 (2905 → 4950) → 3 elektron valensi → Aluminium (Al), Z = 13
- A: Lonjakan besar dari ke-7 ke-8 (11000 → 33604) → 7 elektron valensi → Klorin (Cl), Z = 17
-
Urutan Jari-jari Atom
Dalam satu periode (periode ke-3), semakin ke kanan dalam tabel periodik, jari-jari atom makin kecil. Hal ini karena:- Jumlah kulit tetap (kulit ketiga)
- Muatan inti makin besar menarik elektron lebih kuat
- D (Al) > B (S) > A (Cl) > C (Ar)
- Jumlah kulit tetap (kulit ketiga)
✅ Jawaban yang tepat B
Ini sesuai dengan urutan jari-jari atom dalam satu periode berdasarkan gaya tarik inti yang makin kuat ke kanan tabel periodik.
Soal OSN Kab/Kota tentang Ikatan Ion Kompleks/Koordinasi
Berikut adalah struktur ligan dietilentriaamin (dien).
Jumlah isomer yang dimiliki oleh ion [Fe(dien)2]2+ adalah ....
- 1
- 2
- 4
- 6
- 8
Dien adalah ligan tridentat, dua ligan dien akan mengelilingi ion Fe²⁺, membentuk geometri oktahedral. Dalam kompleks oktahedral dengan dua ligan tridentat, terdapat kemungkinan isomer facial (fac) dan meridional (mer).
Isomer Facial (fac): Ketiga atom donor dari setiap ligan dien menempati tiga posisi yang saling bersebelahan (membentuk satu muka oktahedron).
Isomer Meridional (mer): Ketiga atom donor dari setiap ligan dien menempati posisi yang membentuk garis meridian (tidak bersebelahan).
Jawaban yang tepat B
Ringkasan tentang isomer ion kompleks bentuk oktahedral dengan ligan monodentat yang dapat diadaptasi untuk bidentat/tridentat dapat baca lebih lanjut di sini.
Soal OSN Kab/Kota tentang Orbital Molekul
Pernyataan berikut yang benar mengenai spesi NF, NF+, dan NF– adalah ....
- NF bersifat diamagnetik
- Panjang ikatan tertinggi dimiliki oleh NF–
- HOMO semua spesi adalah orbital π*
- Orde ikatan NF adalah 2,5
- Semua benar
- (I), (II), (III) benar
- (I), (II), (IV) benar
- (II) dan (III) benar
- (III) dan (IV) benar
Analisis Pernyataan Mengenai Spesi NF, NF+, dan NF–
(I) NF bersifat diamagnetik
Salah. Diagram orbital molekul (MO) NF menunjukkan adanya 2 elektron tidak berpasangan (masing-masing di π*2px dan π*2py), sehingga NF bersifat paramagnetik.
(II) Panjang ikatan tertinggi dimiliki oleh NF–
Benar. NF– menambah satu elektron ke orbital antibonding π*, menurunkan orde ikatan menjadi 1,5 dan menyebabkan panjang ikatan paling besar.
(III) HOMO semua spesi adalah orbital π*
Benar. Pada NF, NF+, dan NF–, elektron tertinggi (HOMO) menempati orbital π*2p. Maka HOMO ketiganya memang berada pada orbital π*.
(IV) Orde ikatan NF adalah 2,5
Salah. Berdasarkan MO, orde ikatan NF dihitung sebagai:
(10 elektron bonding – 6 antibonding)/2 = 2,0. Bukan 2,5.
Ringkasan:
| Opsi | Pernyataan | Hasil |
|---|---|---|
| I | NF diamagnetik | ❌ Salah |
| II | Panjang ikatan tertinggi di NF– | ✅ Benar |
| III | HOMO semua spesi adalah orbital π* | ✅ Benar |
| IV | Orde ikatan NF = 2,5 | ❌ Salah |
Jawaban yang tepat D
Referensi detail untuk pembahasan ini dapat dibaca di sini.
Soal OSN Kab/Kota tentang Struktur Lewis Stabil
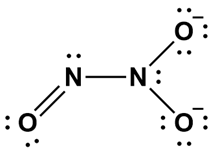
Ion trioksodinitrat (N2O32–) memiliki kerangka struktur Lewis sebagai berikut.
Berdasarkan struktur Lewis yang paling stabil, pernyataan manakah di bawah ini yang benar?
- Struktur tersebut mengandung 2 ikatan pi
- Semua atom berada pada bidang yang sama (planar)
- Semua atom N memiliki muatan formal 0
- Semua ikatan N-O memiliki panjang ikatan yang sama
- Struktur tersebut memiliki 3 struktur resonansi lain yang ekuivalen
Bentuk struktur Lewis paling stabil dari Ion trioksodinitrat (N2O32–) sebagai berikuit.
Syarat strktur Lewis stabil setidaknya: Oktet terpenuhi; Elektron total sesuai; Muatan formal minimum; Muatan diletakkan secara logis; Tidak ada ikatan “mustahil”; Jika bisa, punya resonansi ekuivalen.
Muatan formal = jumlah elektron valensi – jumlah elektron bebas – ½ elektron yang digunakan berikatan.
| Pilihan | Pernyataan | Evaluasi |
|---|---|---|
| A | Struktur tersebut mengandung 2 ikatan pi |
Karena hanya ada 1 ikatan rangkap maka hanya ada 1 ikatan pi |
| B | Semua atom berada pada bidang yang sama (planar) |
Salah (N di kanan berbentuk trigonal piramida) |
| C | Semua atom nitrogen memiliki muatan formal 0 |
Benar |
| D | Semua ikatan N-O memiliki panjang ikatan yang sama |
Salah (karena ada 2 macam ikatan (ikatan tungga dan rangkap, tidak mungkin sama panjang ikatannya) |
| E | Senyawa tersebut memiliki 3 struktur resonansi ekuivalen |
Salah (hanya 2 yang ekuivalen) |
Soal OSN Kab/Kota tentang Stoikiometri
Sebanyak 50 cm3 suatu gas yang kemungkinan termasuk golongan alkana, alkena, atau alkuna membutuhkan 325 cm3 oksigen untuk pembakaran sempurnanya (kedua volume diukur pada T dan P yang sama). Gas tersebut memiliki rumus molekul ....
- C4H8
- C4H10
- C4H14
- C8H14
- C8H18
Pembahasan Soal
Untuk menentukan rumus molekul gas hidrokarbon (alkana, alkena, atau alkuna) yang bereaksi sempurna dengan oksigen, kita dapat menggunakan data volume gas dan volume oksigen yang diperlukan pada kondisi suhu dan tekanan yang sama (T dan P).
Berikut langkah-langkah penyelesaiannya:
1. Persamaan Reaksi Umum Pembakaran Hidrokarbon
Reaksi pembakaran sempurna hidrokarbon (\( C_xH_y \)) dengan oksigen (\( O_2 \)) menghasilkan karbon dioksida (\( CO_2 \)) dan air (\( H_2O \)):
$$ \begin{aligned} C_xH_y + \left( x + \frac{y}{4} \right) O_2 \rightarrow x CO_2 + \frac{y}{2} H_2O \end{aligned} $$2. Perbandingan Volume Gas
Pada kondisi suhu dan tekanan yang sama, perbandingan volume gas setara dengan perbandingan koefisien reaksi. Diketahui:
- Volume \( C_xH_y = 50 \, \text{cm}^3 \)
- Volume \( O_2 = 325 \, \text{cm}^3 \)
Perbandingan volume \( C_xH_y : O_2 = 50 : 325 = 1 : 6,5 \).
Sehingga, dari persamaan reaksi:
$$ \begin{aligned} 1 \text{ volume } C_xH_y \text{ membutuhkan } \left( x + \frac{y}{4} \right) \text{ volume } O_2 \end{aligned} $$Dari perbandingan volume:
$$ \begin{aligned} x + \frac{y}{4} = 6,5 \end{aligned} $$3. Menentukan Rumus Molekul
Kita cari nilai \( x \) dan \( y \) yang memenuhi persamaan di atas untuk golongan alkana, alkena, atau alkuna.
a. Alkana (\( C_nH_{2n+2} \)):
- \( x = n \)
- \( y = 2n + 2 \)
Substitusi ke persamaan:
$$ \begin{aligned} n + \frac{2n + 2}{4} &= 6,5 \\ n + 0,5n + 0,5 &= 6,5 \\ 1,5n &= 6 \\ n &= 4 \end{aligned} $$Sehingga rumus molekulnya adalah \( C_4H_{10} \) (Butana).
b. Alkena (\( C_nH_{2n} \)):
- \( x = n \)
- \( y = 2n \)
Substitusi ke persamaan:
$$ \begin{aligned} n + \frac{2n}{4} &= 6,5 \\ n + 0,5n &= 6,5 \\ 1,5n &= 6,5 \\ n &= \frac{13}{3} \approx 4,33 \end{aligned} $$Nilai \( n \) bukan bilangan bulat, sehingga tidak memenuhi.
c. Alkuna (\( C_nH_{2n-2} \)):
- \( x = n \)
- \( y = 2n - 2 \)
Substitusi ke persamaan:
$$ \begin{aligned} n + \frac{2n - 2}{4} &= 6,5 \\ n + 0,5n - 0,5 &= 6,5 \\ 1,5n &= 7 \\ n &= \frac{14}{3} \approx 4,67 \end{aligned} $$Nilai \( n \) juga bukan bilangan bulat, sehingga tidak memenuhi.
4. Kesimpulan
Hanya alkana dengan \( n = 4 \) (\( C_4H_{10} \)) yang memenuhi persamaan dengan nilai \( n \) bulat. Oleh karena itu, rumus molekul gas tersebut adalah: $C_4H_{10} $.
Jawaban yang tepat B.
Soal OSN Kab/Kota tentang Kristal
Suatu material kristalin dianalisis menggunakan difraksi sinar-X dengan radiasi Cu Ka(l = 1,5406 Å). Puncak difraksi orde pertama teramati pada sudut 2q = 30,0 °C. Berapakah jarak antarbidang kristal (d-spacing) yang sesuai dengan puncak ini?
- 0,100 nm
- 0,154 nm
- 0,257 nm
- 0,298 nm
- 0,308 nm
Perhitungan Jarak Antarbidang Kristal (d-spacing) dalam Difraksi Sinar-X
Untuk menentukan jarak antarbidang kristal (\( d \)) menggunakan hasil difraksi sinar-X, kita menggunakan Hukum Bragg:
Diketahui:
- Panjang gelombang sinar-X (\(\lambda\)) = 1,5406 Å = \(1,\!5406 \times 10^{-10}\) m
- Sudut difraksi (\(2\theta\)) = 30,0°
- Orde difraksi (\(n\)) = 1
Langkah Penyelesaian:
- Menghitung \(\theta\) (sudut setengah dari \(2\theta\)):
\[ \begin{aligned} \theta &= \frac{2\theta}{2} \\ &= \frac{30,\!0^\circ}{2} \\ &= 15,\!0^\circ \end{aligned} \]
- Substitusi nilai-nilai ke dalam Hukum Bragg:
\[ \begin{aligned} 1 \times 1,\!5406 \times 10^{-10} &= 2d \sin(15,\!0^\circ) \end{aligned} \]
- Menghitung \(\sin(15,\!0^\circ)\):
\[ \begin{aligned} \sin(15,\!0^\circ) &\approx 0,\!2588 \end{aligned} \]
- Menyelesaikan untuk \(d\):
\[ \begin{aligned} d &= \frac{1,\!5406 \times 10^{-10}}{2 \times 0,\!2588} \\ &= \frac{1,\!5406 \times 10^{-10}}{0,\!5176} \\ &\approx 2,\!976 \times 10^{-10} \, \text{m} \\ &= 0,\!298 \, \text{nm} \end{aligned} \]
Jawaban yang tepat D.




2%5D2+.png)


Tidak ada komentar:
Posting Komentar